|
углы большие прямого, казалось весьма невероятным. Резерфорд говорил, что
это так же невероятно, как если бы пуля отскакивала от листа папиросной
бумаги.
Одно из возможных объяснений аномального рассеяния состояло в том что оно
складывается из многих небольших углов отклонений, вызванные атомами
рассеивающего вещества.
Исходя из модели Томсона, Резерфорд подсчитал, что это не может давать
больших отклонений даже при многих столкновениях с частицей. И здесь
Резерфорд обратился к планетарной модели.
Когда а-частица проходит мимо заряженного ядра, то под воздействием кулоновской
силы, пропорциональной заряду ядра и заряду а-частицы и обратно
пропорциональной квадрату расстояния между ними, она движется по гиперболе,
удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким
образом, искривляется, и она отклоняется на угол рассеяния ф.
1 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад
«Рассеяние а- и b-лучей и строение атома». В докладе он говорил: «Рассеяние
заряженных частиц может быть объяснено, если предположить такой атом,
который состоит из центрального электрического заряда, сосредоточенного в
точке и окруженного однородным сферическим распределением противоположного
электричества равной величины. При таком устройстве атома а- и b-частицы,
когда они проходят на близком расстоянии от центра атома, испытывают большие
отклонения, хотя вероятность такого отклонения мала».
Резерфорд рассчитал вероятность такого отклонения и показал, что она
пропорциональна числу атомов п в единице рассеивающего материала,
толщине рассеивающей пластинки и величине b2, выражаемой
следующей формулой:
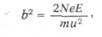
где Ne— заряд в центре атома, Е—заряд отклоняемой частицы, т—ее
масса, и—ее скорость. Кроме того, эта вероятность зависит от угла
рассеяния ф, так что число рассеянных частиц на единицу площади
пропорционально cosec4 (Ф/2).
Важным следствием теории Резерфорда было указание на заряд атомного центра,
который Резерфорд положил равным ± Ne. Заряд оказался
пропорциональным атомному весу.
В 1913 г. Гейгер и Марсден предприняли новую экспериментальную проверку
формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими
сцинтилляционным вспышкам. Из этих исследований и возникло представление о
ядре как устойчивой части атома, несущей в себе почти всю массу атома и
обладающей положительным зарядом. При этом число элементарных зарядов
оказалось пропорциональным атомному весу.
В 1913 г. Ван ден Брук показал, что заряд ядра совпадает с номером элемента в
таблице Менделеева. В том же1913 г. Ф. Содди и К. Фаянс пришли закону
смещения Содди—Фаянса, ее гласно которому при а-распаде радиоактивный
продукт смещается в менделеевской таблице на два номера выше а при b-
распаде—на номер ниже. К этому же времени Содди пришел представлению об
изотопах как разновидностях одного и того же элемент ядра атомов которых
имеют одинаковый заряд, но разные массы.
В богатом событиям 1913 г. были опубликованы три знаменитые статьи Бора «О
строении атомов и молекул», открывшие путь к атомной квантовой механике.
Томас Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне
под названием «камера Вильсона». Этот прибор позволяет видеть заряженную
частицу по оставляемому ею туманному следу.
Позднее ученик и сотрудник Резерфорда Блэккет (1897—1974) получил
вильсоновскую фотографию расщепления ядра азота а-частицей, первой ядерной
реакции, открытой Резерфордом.
В этом же году Бор, имевший возможность поработать с автором первой модели
атома, а затем с автором планетарной модели, на основе последней создает свою
теорию атома Резерфорда-Бора.
Знаменитая статья Бора, в которой были заключены основы этой теории,
начиналась с указания на модели Резерфорда и Томсона и обсуждения их
особенностей и различий.
Резерфорд сразу понял революционный характер идей Бора и высказал
критические замечания по самым фундаментальным пунктам теории Бора. После
длительных дискуссий статья Бора и две его последующие статьи были
опубликованы. Однако окончательный ответ на возражения Резерфорда был дан
только созданием квантовой механики.
В 1915 г. Бор опубликовал работы «О сериальном спектре водорода и строении
атома» и «Спектр водорода и гелия», «О квантовой теории излучения в структуре
атома». Он развил исследования, выполненные им в Манчестере в августе 1912
г., и опубликовал их под названием «Теория торможения заряженных частиц при
их прохождении через вещество».
В декабре 1915 и январе 1916 г. Арнольд Зоммерфельд (1868—1951) развил
теорию Бора, рассмотрев движение электрона по эллиптическим орбитам и
обобщив правила квантования Бора. Зоммерфельд дал также теорию тонкой
структуры спектральных линий, введя релятивистское изменение массы со
скоростью. В его расчеты вошла безразмерная универсальная постоянная тонкой
структуры:
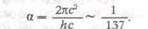
Теория атома после открытия Зоммерфельда стала называться теорией Бора —
Зоммерфельда.
Продолжая развивать свои идеи, Бор сформулировал принцип соответствия
(1918), означавший шаг вперед в ответе на вопросы, поставленные Резерфордом.
В 1922 г. Бор получил Нобелевскую премию по физике. В нобелевском докладе он
развернул картину с стояния атомной теории к этому времени. Одним из наиболее
существенных успехов теории было нахождения. ключа к периодической системе
элементов, которая объяснялась наличие электронных оболочек, окружающих ядра
атомов.
В 1925 г. работой Гейзенберга началось создание квантовой механики. В том же
году Уленбек и Гаудсмит, работавшие у Эренфеста, открыли спин электрона, а
Паули открыл принцип, носящий ныне его имя. После открытия Гейзенбергом в
1927 г. принципа неопределенности Бор выдвинул в качестве основной
теоретической идеи квантовой теории принцип дополнительности.
В 1936 г. Бор выступил со статьей «Захват нейтрона и строение ядра», в
которой предложил капельную модель ядра и механизм захвата нейтрона ядром.
Ядерной физике была посвящена также работа 1937 г. «О превращении атомных
ядер, вызванных столкновением с материальными частицами».
В конце 1938—начале 1939 г. было открыто деление урана.
Бор, как и Томсон до него, ищет такое расположение электронов в атоме,
которое объяснило бы его физические и химические свойства. Бор уже знает о
модели Резерфорда и берет ее за основу. Ему известно также, что заряд ядра и
число электронов в нем, равное числу единиц заряда, определяется местом
элемента в периодической системе элементов Менделеева. Таким образом, это
важный шаг в понимании физико-химических свойств элемента. Но остаются
непонятными две вещи: необычайная устойчивость атомов, несовместимая с
представлением о движении электронов по замкнутым орбитам, и происхождение
их спектров, состоящих из вполне определенных линий. Такая определенность
спектра, его ярко выраженная химическая индивидуальность, очевидно, как-то
связана со структурой атома.
Устойчивость атома в целом противоречит законам электродинамики, согласно
которым электроны, совершая периодические движения, должны непрерывно
излучать энергию и, теряя ее, «падать» на ядро. К тому же и характер движения
электрона, объясняемый законами электродинамики, не может приводить к таким
характерным линейчатым спектрам, которые наблюдаются на самом деле.
Линии спектра группируются в серии, они сгущаются в коротковолновом «хвосте»
серии, частоты линий соответствующих серий подчинены странным
арифметическим законам.
Так, Иоганн Бальмер в 1885 г. нашел, что четыре линии водорода На, Нb, Нg,
Hs имеют длины волн, которые могут быть выведены из одной формулы:
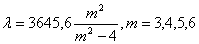
Позже было найдено еще два десятка линий в ультрафиолетовой части, и их
длины волн также укладывались в формулу Бальмера.
Иоганн Ридберг в 1889-1900 гг. нашел, что и линии спектров щелочных металлов
могут быть распределены по сериям. Частоты линий каждой серии могут быть
представлены в виде разности двух членов—термов. Так, для главной серии
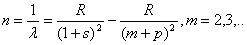
где R — некоторое постоянное число, получившее название постоянной
Ридберга, s и р — дробные поправки, меняющиеся от серии к серии.
«Основным результатом тщательного анализа видимой серии линейчатых спектров
и их взаимоотношений, — писал Бор,—было установление того факта, что частота
v каждой линии спектра данного элемента может быть представлена с
необыкновенной точностью формулой v =T’—T”, где T' и T" — какие-то два члена
из множества спектральных термов T, характеризующих элемент».
Бору удалось найти объяснение этого основного закона спектроскопии и
вычислить постоянную Ридберга из таких фундаментальных величин, как заряд и
масса электрона, скорость света и постоянная Планка. Но для этого ему
пришлось ввести в физику атома представления о стационарных состояниях
атомов, находясь в которых электрон не излучает, хотя и совершает
периодическое движение по круговой орбите.
Для таких состояний момент импульса равен кратному от h/2p. При переходе с
одной орбиты на другую электрон излучает и поглощает энергию, равную кванту.
В заключительных замечаниях к трем своим статьям «О строении атомов и
молекул» Бор формулирует свои основные гипотезы следующим образом:
«I. Испускание (или поглощение) энергии происходит не непрерывно, как это
принимается в обычной электродинамике, а только при переходе системы из
одного «стационарного» состояния в другое.
2. Динамическое равновесие системы в стационарных состояниях определяется
обычными законами механики, тогда как для перехода системы между различными
стационарными состояниями эти законы не действительны.
3. Испускаемое при переходе системы из одного стационарного состояния в другое
излучение монохроматично, и соотношение между его частотой v и общим
количеством излученной энергии Е дается равенством E=hv, где
h — постоянная Планка.
4. Различные стационарные состояния простой системы, состоящей из вращающегося
вокруг положительного ядра электрона, определяются из условия, что отношение
между общей энергией, испущенной при образовании данной конфигурации, и числом
оборотов электрона является целым кратным h/2p. Предположение о том,
что орбита электрона круговая, равнозначно требованию, что момент им пульса
вращающегося вокруг ядра электрона был бы целым кратным h/2p.
5. «Основное» состояние любой атомной системы, т. е. состояние, при
котором излученная энергия максимальна, определяется из условия, чтобы момент
импульса каждого электрона относительно центра его орбиты равнялся h/2p».
Далее Бор пишет: «Было показано, что при этих предположениях с помощью
модели атома Резерфорда можно объяснить законы Бальмера и Ридберга,
связывающие частоты различных линий в линейчатом спектре».
Именно Бор получил для спектра водорода формулу:
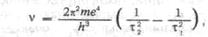
где t — целые числа.
«Мы видим,—пишет Бор,—что это соотношение объясняет закономерность, связывающую
линии спектра водорода. Если взять t2 = 2 и варьировать t1
, то получим обычную серию Бальмера. Если взять t2=3, получим в
инфракрасной области серию, которую наблюдал Пашен и еще ранее предсказал
Ритц. При t2=1и t2=4,5,... получим в крайней
ультрафиолетовой и соответственной крайней инфракрасной областях серии,
которые еще не наблюдались, но существование которых можно предположить ».
Действительно, серия в ультрафиолетовой области, соответствующая t2=
1, была найдена Лайманом в 1916 г., серия в инфракрасной области,
соответствующая t2=4 была найдена Брэкетом в 1922 г., и серия t
2=5 была найдена Пфундом в 1924 г.
Используя известные в то время значения е, т, h, Бор вычислил значение
Страницы: 1, 2, 3, 4, 5
| 


